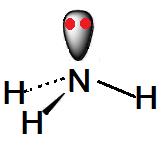
Hola a todos. Hoy voy a hablarles sobre la hibridación del nitrógeno y repulsión electrostática. Aunque no lo parezca, esta temática bastante común en las clases de química.
El amoniaco, su fórmula molecular NH3 y modelo molecular AB3E, su estructura según Lewis nos revela que tiene 3 enlaces enlazantes con el hidrógeno (N-H) y un enlace no enlazante (N-N) con el propio Nitrógeno.
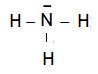
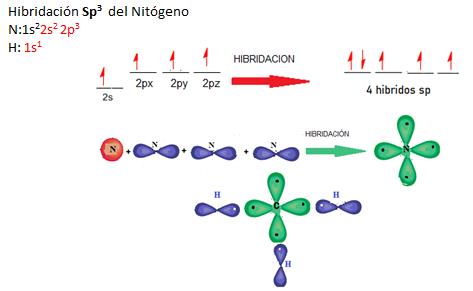
El Nitrógeno tiene 5 electrones en su último nivel, como átomo central tiene una hibridación del tipo Sp3, con número de coordinación 4sp, con 1 e- libre en tres de sus enlaces ( N-H), y el hidrógeno tiene un único electrón en su orbital también único (1s), los electrones libres del Nitrógeno se combinan con los electrones del Hidrógeno por medio de enlaces tipo σsp _σs (N-H), para formar el Amoniaco.
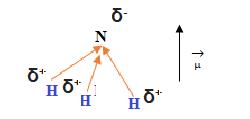
Es una molécula polar, la polaridad no se anula, una parte de la molécula se acumula una carga negativa ( δ-), mientras en la parte opuesta se acumula carga positiva ( δ+).
A simple vista, el Amoniaco debería tener una geometría tetraédrica con un ángulo entre los pares de enlace N-H de 109, 5º, pero en realidad esto no es así y lo explica La teoría de repulsión de pares de electrones de (la capa de) valencia (TRPECV).
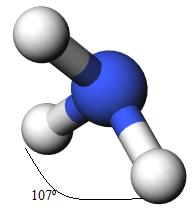
El par de electrones no enlazantes (N-N), repelen a los demás enlaces y lo alejan de él, haciendo que los ángulos entre los enlaces enlazantes (N-H) sean más pequeño, e igual a 107º, y su geometría molecular ya no coincide con la geometría electrónica tethahedríca, sino que será Piramidal trigonal.